Syndrome d'apnée du sommeil et risque cardiovasculaire
Dr Maxime Stutz et Dr Julien Favier, Roanne
Avril 2024
I. Définitions
Le syndrome d’apnée du sommeil a été officiellement qualifié pour la première fois en 1972 par un médecin français, le Dr Christian Guilleminault. Dans sa forme obstructive, il s’agit d’une pathologie caractérisée par des rétrécissements ou fermetures répétés des voies aériennes supérieures tandis que les efforts respiratoires persistent, au moins pendant une partie des évènements. Dans sa forme centrale, un défaut de la commande ventilatoire et/ou des effecteurs entrainent une diminution ou une absence des efforts ventilatoires. Les deux types d’évènements peuvent coexister en des proportions variables. On parle d’hypopnée lorsque le flux aérien nasobuccal est réduit et d’apnée lorsqu’il est interrompu, ceci, par convention, pendant au moins 10 secondes.
Deux conséquences peuvent alors en découler : un bref réveil et/ou une baisse de la saturation en oxygène. Ces évènements, s’ils se reproduisent, fragmentent le sommeil, induisent une hypoxie intermittente et altèrent en particulier la santé cardiovasculaire (1).
On définit la maladie syndrome d’apnées-hypopnées du sommeil comme l’association de symptômes nocturnes (polyurie, suffocation, ronflement gênant, hypersudation), diurnes (somnolence diurne excessive (SDE), fatigue matinale, irritabilité, baisse de l’humeur, dysfonction érectile, troubles attentionnels) et d’un Index d’Apnée Hypopnées > à 5/h, pour lesquels il n’y a pas de meilleure explication que les évènements respiratoires pendant le sommeil (2). La Classification Internationale des Troubles du Sommeil (ICSD-3-TR) définit la somnolence diurne excessive comme l’incapacité à rester éveillé(e) et alerte pendant la journée, ce qui entraîne des périodes de besoin irrépressible de sommeil ou des épisodes involontaires de somnolence ou de sommeil (3).
II. Epidémiologie
Près d’un milliard de personnes dans le monde présentent au moins des symptômes de stade légers (4). En France et en Suisse, c’est entre 4 et 11% de la population générale qui est concernée (5,6). Parmi les principaux facteurs de risque de développer un syndrome d’apnée du sommeil, on retrouve l’âge (avec une fréquence croissante jusqu’à 70 ans), le sexe (6% de femmes sont concernées contre 10 à 12% des hommes, ces derniers étant 2 à 4 fois plus nombreux que les femmes avant 60ans), le surpoids et l’obésité.
On retrouve une coexistence significative des troubles respiratoires obstructifs du sommeil et des pathologies cardiovasculaires reflétant à la fois des relations causales mais aussi des facteurs de risques partagés (7).
L’hypertension artérielle est la maladie chronique la plus fréquente dans le monde. Elle concerne un adulte sur trois en France (8). Parmi les patients hypertendus, plus d’un sur trois présente un SAOS et cela s’élève à plus de 8 patients sur 10 lorsqu’il est question d’une HTA résistante (9,10). Le SAOS figure d’ailleurs comme facteur de risque d’HTA résistante (11). La fibrillation atriale concerne 2 à 4% de la population générale, ce qui en fait le trouble du rythme cardiaque le plus fréquent (12). Dans une population apnéique, cette prévalence est d’environ 5% et l’incidence est plus de x2 supérieure à une population non apnéique (13). Parmi les patients qui ont présenté un épisode de syndrome coronarien aigu, environ un sur deux s'avère être apnéique à un stade modéré, et un sur quatre à un stade sévère (14). Un syndrome d’apnée du sommeil de stade modéré est enfin retrouvé chez 36% à 70% des patients insuffisants cardiaques (15).
En outre, un patient qui présente un SAS de stade sévère a x2 plus de risques de présenter un évènement cardiovasculaire sévère indésirable et x3 plus de risque de décéder de cause cardiaque (16).
III. Physiopathologies et complications vasculaires
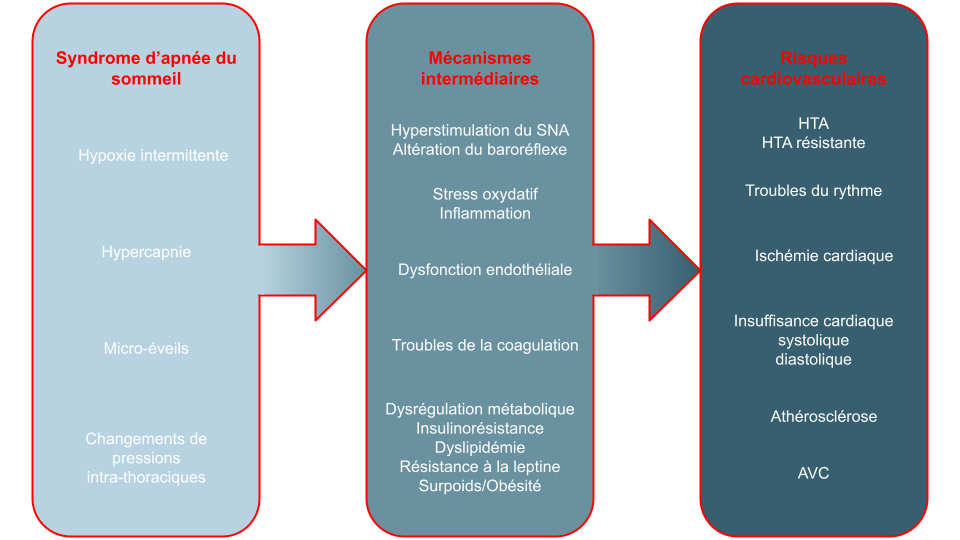
Les composantes physiopathologiques du SAS impliqués dans le développement des maladies cardiovasculaires sont multiples :
-
Les évènements respiratoires (micro-éveillant et/ou désaturant) engendrent une fragmentation du sommeil par une hyperstimulation du système nerveux autonome sympathique. Celle-ci agit aux niveaux des vaisseaux sanguins périphériques et se traduit par une vasoconstriction et des accélérations de la fréquence cardiaque (17). A terme, elle altère le baroréflexe dont le rôle est de réguler les variations de tension artérielle au cours du sommeil mais aussi à l’éveil (17,18).
-
Les épisodes répétés d’hypoxies-reperfusions sont à l’origine d’une augmentation des taux de médiateurs inflammatoires circulants et de radicaux libres. Ces mécanismes moléculaires et cellulaires affectent le fonctionnement de l’endothélium entrainant des vasoconstrictions soutenues et l’accélération du développement de l’athérosclérose (19,20).
-
Les évènements respiratoires vécues par le patient vont induire une altération des métabolismes lipidiques et glucidiques, indépendamment de l’obésité (21). L’hypoxie intermittente est à l’origine d’une inflammation du tissus adipeux et de dysfonctions des cellules béta-pancréatiques. Il en découle une hausse des taux de LDL-c ainsi qu’une insulinorésistance (22,23).
IV. Diagnostic du SAHOS
Le diagnostic de syndrome d’apnées du sommeil repose sur deux examens :
- la polygraphie ventilatoire (PGV ou PV) qui étudie les paramètres de la respiration au cours du sommeil. Il s’agit d’un examen qui enregistre le flux respiratoire par une canule nasale, les mouvements respiratoires par des sangles thoraco-abdominales, l’oxymétrie, la fréquence cardiaque, voire la position corporelle et les bruits trachéaux.
- la polysomnographie (PSG) qui associe des capteurs électroencéphalographiques (EEG, pour l’activité cérébrale), électro-oculographiques (EOG, pour les mouvements oculaires) et électromyographiques (EMG, pour l’activité des muscles) qui permettent de scorer les stades de sommeil, et des capteurs mécaniques qui enregistrent les différents paramètres respiratoires (ceinture thoracique et abdominale, flux ou débit nasobuccal, oxymétrie).
La polygraphie comme la polysomnographie permettent de détecter les arrêts (apnées) ou baisses (hypopnées) du flux d’air mesurés au niveau du nez et de la bouche et d’apprécier la présence ou absence concomitante d’efforts respiratoires au niveau du thorax et de l’abdomen. La présence d’efforts signe un obstacle au niveau des voies aériennes supérieures et les apnées/hypopnées sont alors qualifiées d’obstructives. En l’absence d’effort respiratoire (ou de majoration de ceux-ci), les apnées/hypopnées sont dites centrales car c’est la commande en provenance des centres respiratoires qui fait ici défaut (24).
Les apnées sont définies par une chute du débit aérien nasobuccal d’au moins 90% par rapport aux amplitudes des cycles ventilatoires antérieurs, évoluant pendant au moins 10s. La définition des hypopnées varie selon que l’on se réfère aux normes françaises ou aux normes américaines. D’après les règles de scoring SPFL 2010, une hypopnée correspond à une réduction du débit aérien nasobuccal de 50% à 90%. Elle peut être inférieure à 50% mais doit dans ce cas être associée à une désaturation (baisse d’au moins 3% de Sp02) et/ou à un micro-éveil cortical. La définition de l’AASM est plus stricte et retient une hypopnée en présence d’une réduction du débit aérien nasobuccal de 30% à 90% qui doit systématiquement être associée à une désaturation (baisse d’au moins 3% de Sp02) et/ou à un micro-éveil cortical. Dans tous les cas, l’hypopnée doit être observée sur au moins 10s.
Ces définitions permettent le calcul de l’Index d’Apnée Hypopnée qui est classiquement utilisé pour apprécier la sévérité de trouble respiratoire du sommeil observé. Trois niveaux sont établis : entre 5 à 15 par heure, le SAS est considéré comme léger, entre 15 et 30, il est modéré. Au-delà de 30, il est sévère.
Les micro-éveils sont de brèves réactions électroencéphalographiques qui témoignent de la fragmentation du sommeil. Ils ne peuvent donc être évalués qu’au travers la réalisation d’une polysomnographie. Ils surviennent en fin d’apnée ou hypopnée et accompagnent la reprise ventilatoire mais ne sont que rarement perçus. Le patient rapportera plutôt l’impression de sommeil superficiel et non réparateur.
La polygraphie ventilatoire ne permet pas d’apprécier le sommeil au sens neurologique du terme et les hypopnées micro-éveillantes. Elle aura donc tendance à sous-évaluer l’IAH qui sera exprimé en nombre d’évènements par heure d’analyse (versus par heure de sommeil avec la polysomnographie). Une polygraphie ventilatoire négative impose donc lorsque la symptomatologie est évocatrice, notamment en présence d’une somnolence diurne, la réalisation d’une polysomnographie complémentaire.
Pour cette raison, une polygraphie est indiquée dans le cadre d’une recherche de SAS, si la suspicion pré-test est modérée à forte et qu’il n’est pas suspecté d’autre trouble du sommeil ou en cas d’évaluation de l’efficacité d’un traitement ventilatoire déjà en place. Dans tous les autres cas, il est recommandé d’avoir recours à une polysomnographie.
Les deux enregistrements peuvent être réalisés en laboratoire de sommeil, surveillés en continue par du personnel qualifié, surveillés en discontinue par du personnel non dédié ou enfin à domicile.
V. Prédiction du risque CV associé aux apnées du sommeil
L'interrelation physiopathologique étroite entre troubles respiratoires du sommeil et pathologies cardiovasculaires soulève la question suivante : est-il possible de prédire le risque cardiovasculaire qui s’associe à un trouble respiratoire du sommeil ?
D’après le marqueur historique de sévérité du SAS : l’IAH.
L’IAH est à ce jour le marqueur référence de la sévérité du SAS. En 2005, l'étude de Marin et al. a mis en évidence un lien entre IAH et incidence augmentée des évènements cardiovasculaires en population masculine (25). Quelques années plus tard, l’étude de Tetyana et al. est venu contredire ce résultat en ajustant les données de leur cohorte, aux facteurs de risques cardiovasculaires associés (26) et la cohorte HypnoLaus réalisée en population générale, concluait à l’absence de différence significative en termes de survenue d’évènement cardiovasculaire selon que l’IAH soit supérieur ou inférieur à 15 (cut-off stade léger-modéré) (6). D’autres études soulignent un impact proportionnel de l’IAH sur les niveaux de tension artérielle de patients âgés de plus de 65ans asymptomatiques sur le plan somnologique et cardiologique (27), le développement prématuré d’une dilatation atriale et d’une cardiopathie hypertrophique hypertensive chez des patients associant HTA et SAOS que chez des hypertendus simples (28), le développement accéléré d’athérosclérose carotidienne (29). Ces résultats contrastés ont mené à s’intéresser à de nouveaux biomarqueurs plus à même d’apprécier les conséquences physiologiques des évènements respiratoires en termes de santé cardiovasculaire et d’évaluer leurs pronostics à moyen et long terme.
Exemples de nouveaux marqueurs du RCV dans le SAS :
L’Hypoxic burden ou charge hypoxique, reflète l’hypoxémie nocturne. A l’inverse de l’IDO (index de désaturation en oxygène) qui correspond au nombre de désaturations par heure, l’hypoxic burden apprécie les périodes de désaturations en considérant leur durée et leur profondeur (aires de désaturations en % minute) pour une période donnée (par heure d’analyse ou de sommeil). Un marqueur très proche de l’hypoxic burden est le temps passé sous une valeur donnée de saturation (classiquement Sp02 inférieure 90%). Ces marqueurs ont à la fois été associés à une réduction de la survie en l’absence d’évènement cardiovasculaire (30) mais également à un surrisque de mortalité par évènement cardiovasculaire (31,32).
Le PWAD (Pulse Wave Amplitude Drops) index ou diminution de l’amplitude d’onde de pouls, reflète la vasoconstriction périphérique qui témoigne d’une activation du système sympathique. Cette activation se produit, en autre, au décours d’un évènement respiratoire telle qu’une apnée ou hypopnée. Le PWAD index diminue avec l’âge et lors du développement de maladies cardiovasculaires (33). L’association d’un SAHOS et d’un PWAD index diminué est par ailleurs associée à un surrisque cardiovasculaire, en prévention primaire et secondaire, comparativement au fait de présenter, isolément, l’un ou l’autre de ces facteurs (34).
Le Delta-Heart Rate Response ou l’accélération de la fréquence cardiaque en réponse à un évènement respiratoire obstructif, reflète l’activation du système nerveux autonome lors de la reprise respiratoire post-apnée ou post-hypopnée. Il existe une relation en U entre amplitude de la variation de la fréquence cardiaque, probabilité de développer une maladie cardiovasculaire marqueurs cardiovasculaires ou encore des marqueurs biologiques tels que les NT-pro-BNP (35).
La présence d’une somnolence diurne excessive est associée à un risque accru de survenue d’évènement cardiaque majeur indésirable (36). La somnolence semble par ailleurs moduler l’effet du SAOS et augmenter le risque de récidive d’un évènement cardiovasculaire (37). Indépendamment de la sévérité d’un SAOS, la somnolence est associée à une altération plus importante du baroréflexe cardiaque spontané et à une hyperactivation sympathique (38).
VI. Traitements et impact cardiovasculaire
En France, le choix du traitement du patient se définit en fonction des symptômes et de la sévérité du syndrome, mesuré par l’indice d’apnées-hypopnées (IAH). La HAS recommande de traiter les patients dont le SAHOS est modéré ou sévère (IAH>15) et qui présentent au moins trois des symptômes suivants : somnolence diurne, ronflements sévères et quotidiens, sensation d’étouffement ou de suffocation pendant le sommeil, fatigue diurne, nycturie ou encore des céphalées matinales (39).
Plusieurs moyens thérapeutiques existent :
-
La pression positive continue (PPC) est un dispositif qui apporte au patient une pression d’air constante sur l’ensemble du cycle respiratoire. Véritable attelle pneumatique, son rôle est de lever les obstacles des voies respiratoires en les maintenant ouvertes. La PPC est recommandée en première intention lorsque le SAHOS est sévère (IAH >30) ou modéré associé à des comorbidités significatives (IAH >15 et <30 + hypertension artérielle résistante, fibrillation auriculaire récidivante, insuffisance ventriculaire gauche sévère ou maladie coronaire mal contrôlée, antécédent d’accident vasculaire cérébral) ou de mauvaise qualité (>10 micro-éveils par heure de sommeil) (40).
-
L’orthèse d’avancée mandibulaire est un dispositif médical endobuccal dont le rôle est d’avancer la mandibule par rapport à sa position naturelle libérant ainsi de l’espace à l’arrière de la base de langue et augmentant in fine le volume fonctionnel des voies aériennes supérieures. Elle est recommandée en première intention en cas de SAHOS modéré (IAH >15 et <30, non comorbide) ou en tant qu’alternative à la PPC (lorsque celle-ci est non tolérée ou refusée) dans les situations de SAHOS sévère (IAH >30) (41)
-
La chirurgie qui, dans le cas du SAHOS, va s’intéresser aux structures tissulaires ORL (septoplastie, turbinectomie, amygdalectomie, chirurgie de base de langue, UVPP ou encore géniopexie) ou aux structures osseuses (chirurgie d’avancée maxillo-mandibulaire). Cette dernière a pour indications les SAHOS de stade modéré ou sévère, chez un patient cliniquement symptomatique et/ou comorbide, âgé de <65ans, non obèse (IMC<30), au profil dentosquelettique de classe 2 ou 1 ou encore en échec thérapeutique (42).
-
Les mesures hygiéno-diététiques, tant sur le plan métabolique (contrôle pondéral) que somnologique (traitement postural, sevrage tabagique, éthylique ou encore médicamenteux) sont systématiquement recommandées et doivent être associées aux mesures sus-citées, quelle que soit la gravité du SAHOS (43).
-
Les années futures verront certainement se développer de nouvelles options thérapeutiques : la stimulation du XII (ou nerf hypoglosse) qui vise à induire une contraction ciblée des muscles pharyngés lors de la phase inspiratoire ou encore des spécialités médicamenteuses dont les cibles sont là encore le tonus musculaire des voies aériennes supérieures mais aussi les seuils d’éveils ou la commande ventilatoire.
La PPC s’inscrit comme le traitement le plus prescrit en situation de SAOS modéré à sévère.
Une étude basée sur le système national des données de santé a mis en évidence une réduction de du risque de survenue d’une HTA, d’insuffisance cardiaque et de mortalité chez les patients ayant poursuivi leur traitement par PPC comparativement à ceux l’ayant abandonné (44). Une autre étude française a permis de démontrer une relation dose-effet de l’utilisation de la PPC sur la réduction du risque de mortalité de toutes causes et celui de survenue d’un évènement cardiovasculaire indésirable majeur (45). Dans cette même étude, les patients n’ayant pas encore développés de maladie cardiovasculaire et ceux étant somnolents sont ceux qui bénéficiaient le plus des effets cardiovasculaires de la PPC.
L’orthèse d’avancée mandibulaire constitue une réelle alternative thérapeutique à la pression positive continue, y compris sur le plan cardiovasculaire. Ses effets sont comparables à ceux de la PPC en termes de baisse de pression artériel et de mortalité cardiovasculaire à long terme (46,47).
VII. Faut-il dépister le SAS dans les pathologies vasculaires ?
Si syndrome d’apnée du sommeil et pathologies cardiovasculaires sont physiopathologiquement intimement liés, existe-t-il un intérêt à dépister un SAS en présence d’une pathologie cardiovasculaire ?
L’American Heart Association indique à ce jour le dépistage systématique d’un syndrome d’apnée du sommeil en présence d’une HTA difficile à contrôlée voire résistante, d’une hypertension artérielle pulmonaire et d’une fibrillation atriale récidivante (après échec de cardioversion ou ablation). Ce même dépistage est à considérer en présence d’arguments forts de troubles respiratoires du sommeil associés à des troubles du rythme, un AVC, des signes fonctionnels de défaillance cardiaque (NYHA 2 – 4), ou après avoir réchappé à un arrêt cardiaque (48).
Dans l’HTA
Si les baisses de pressions artérielles induites pas l’usage de la pression positive continue ne sont pas significatives en situation d’hypertension artérielle non résistante, il en est autrement en contexte d’HTA résistante, ceci quel que soit la tranche d’âge concernée (49). L’adhérence comme souvent est cruciale puisque l’on retrouve un effet dose-réponse de l’utilisation de la PPC chez les patients HTA résistant : plus l’utilisation est importante, plus la tension artérielle baisse (49). Les patients dits “non-dipper” qu’ils soient non hypertendus ou hypertendus présentent une mortalité accrue par rapport aux patients “dipper” (50). La pression positive continue permet de restaurer un profil dipper et ainsi d’abaisser les risques de complications cardiovasculaires (51). Dans l’étude ALASKA, il apparait que traiter des patients qui ont des indications de PPC permettrait de réduire l'incidence de l’HTA (44).
Dans la FA
Au travers l’hypoxémie nocturne intermittente, l’hyperactivité nerveuse sympathique et vagale et les fluctuations répétées des pressions intrathoraciques et artérielles qu’il engendre, le syndrome d’apnée du sommeil participe à un remodelage élargi des cavités cardiaques (52). Ceci explique la moindre efficacité des traitements antiarythmiques et le plus grand nombre de récidive de FA après cardioversion chez les patients apnéiques (13,53). Le dépistage précoce d’un TROS permet donc d’anticiper et d’adapter les techniques d’ablations à utiliser. La mise en place d’un traitement par pression positive continue est associé à une réduction du remodelage atrial, à une diminution des zones de bas voltage et à une amélioration des vélocités de conduction (54). La PPC est ainsi un complément thérapeutique précieux aux côtés des anti-arythmiques ou des techniques d’ablation électrique.
Dans la maladie coronaire
Dans cette même population, la présence d’un SAHOS est associée à long terme à un surrisque de morbimortalité cardiovasculaire (55). L’effet du SAHOS sur la probabilité de survenue d’un évènement coronarien semble par ailleurs exacerbé par la présence associée d’une somnolence (37). La réévaluation récente des données issues d’essais cliniques randomisés a permis de mettre en avant une baisse de la récidive d’évènements cardiovasculaires en prévention secondaire, chez les patients observant leur traitement par pression positive continue au-delà de 4h/nuit (56). Malgré ces données encourageantes, l’hétérogénéité des patients apnéiques ayant présenté au moins un évènement coronarien ne permet pas de recommander à ce jour un dépistage systématique du SAHOS. L’identification et l’analyse de nouveaux marqueurs du risque cardiovasculaire (hypoxic burden ou delta-heart rate) en situation de SAHOS semble permettre de dégager des sous-populations plus à même de bénéficier des effets de la pression positive continue (57,58). Ces mêmes sous-populations pourraient être dans les années à venir, des cibles de dépistage privilégiées.
Dans l'IC
La présence d’un SAS en cas d’insuffisance cardiaque est délétère en plusieurs points. Cela entraine une altération concomitante de la fonction diastolique (59), une majoration du nombre d’hospitalisations par réadmissions (60) ou encore une plus grande mortalité (61). L’insuffisance cardiaque constitue un cadre pathologique bien spécifique pour deux raisons : premièrement parce qu’elle est l’étiologie la plus fréquente du syndrome d’apnée du sommeil de type central (62) et deuxièmement parce qu’il est ici recommandé de s’assurer de l’optimisation de son traitement (médicamenteux, resynchronisation, ou chirurgical) avant de décider le recours à un traitement ventilatoire (63). Des données récentes viennent appuyer ces recommandations en démontrant les effets positifs sur le syndrome d’apnée du sommeil, des traitements médicamenteux de l’insuffisance cardiaque tels que la supplémentation ferrique (64), l’association sacubitril/valsartan (65) ou encore la dapagliflozine (66).
Lorsqu’un recourt à une ventilation est nécessaire, les données scientifiques convergent pour dire que celle-ci améliore la fraction d’éjection du ventricule gauche mais elles sont à ce jour plus ambivalentes lorsqu’il est question de mortalité (67,68). En 2015, l’étude SERVE-HF avait mis en évidence une augmentation de la mortalité et des évènements cardiovasculaires chez une population de patients IC aFEVG et apnéiques (centraux) traités par ASV (69). Des analyses ultérieures en sous-groupes avancent que les patients qui sont les plus à même de pouvoir bénéficier de telles thérapeutiques sont ceux qui présentent une charge hypoxique significative, ceci, indépendamment de leur FEVG (70). Enfin, traiter efficacement un SAS par ASV permet une meilleure survie et une meilleure qualité de vie (70,71).
Conclusion
Le SAS et les pathologies cardiovasculaires sont des pathologies chroniques qui sont fréquentes et bien souvent coexistantes ce qui constitue un marqueur de sévérité. Les patients concernés par cette association sont néanmoins extrêmement hétérogènes ce qui doit motiver à ce jour des dépistages orientés. La recherche de symptômes nocturnes et/ou diurnes évocateurs doit être une priorité pour cibler les patients les plus à même de pouvoir bénéficier des thérapeutiques existantes. Plus que jamais l’adhérence et l’assiduité aux traitements sont les piliers d’une réduction du risque cardiovasculaire. L’arrivée dans un futur proche et en pratique courante, de nouveaux biomarqueurs devrait permettre de mieux phénotyper les patients et ainsi mieux prédire leur risque cardiovasculaire et leur réponse aux traitements.
Bibliographie
1. Jordan AS, McSharry DG, Malhotra A. Adult obstructive sleep apnoea. The Lancet. 22 févr 2014;383(9918):736‑47.
2. Escourrou P, Meslier N, Raffestin B, Clavel R, Gomes J, Hazouard E, et al. Quelle approche clinique et quelle procédure diagnostique pour le SAHOS ? Rev Mal Respir. oct 2010;27:S115‑23.
3. AASM | Clinical Resources | International Classification of Sleep Disorders [Internet]. American Academy of Sleep Medicine – Association for Sleep Clinicians and Researchers. [cité 11 avr 2024]. Disponible sur: https://aasm.org/clinical-resources/international-classification-sleep-disorders/
4. Benjafield AV, Ayas NT, Eastwood PR, Heinzer R, Ip MSM, Morrell MJ, et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. Lancet Respir Med. 1 août 2019;7(8):687‑98.
5. Communiqué : SAOS: le bon traitement pour le bon patient [Internet]. SFRMS. [cité 11 avr 2024]. Disponible sur: https://www.sfrms-sommeil.org/recherche-2/actualite-scientifique/communique-saos-le-bon-traitement-pour-le-bon-patient/
6. Heinzer R, Vat S, Marques-Vidal P, Marti-Soler H, Andries D, Tobback N, et al. Prevalence of sleep-disordered breathing in the general population: the HypnoLaus study. Lancet Respir Med. avr 2015;3(4):310‑8.
7. Resources – Omnisleep Solutions [Internet]. [cité 11 avr 2024]. Disponible sur: https://omnisleep.in/sleep-apnea-resources/
8. Hypertension artérielle [Internet]. [cité 11 avr 2024]. Disponible sur: https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-cardiovasculaires-et-accident-vasculaire-cerebral/hypertension-arterielle
9. Frequency of Sleep Apnea in Stroke and TIA Patients: A Meta-analysis | Journal of Clinical Sleep Medicine [Internet]. [cité 11 avr 2024]. Disponible sur: https://jcsm.aasm.org/doi/full/10.5664/jcsm.27760
10. Logan AG, Perlikowski SM, Mente A, Tisler A, Tkacova R, Niroumand M, et al. High prevalence of unrecognized sleep apnoea in drug-resistant hypertension. J Hypertens. déc 2001;19(12):2271‑7.
11. Authors/Task Force Members, Mancia G, Fagard R, Narkiewicz K, Redon J, Zanchetti A, et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J. 21 juill 2013;34(28):2159‑219.
12. Saleeb-Mousa J, Nathanael D, Coney AM, Kalla M, Brain KL, Holmes AP. Mechanisms of Atrial Fibrillation in Obstructive Sleep Apnoea. Cells. 19 juin 2023;12(12):1661.
13. Verrier RL, Josephson ME. IMPACT OF SLEEP ON ARRHYTHMOGENESIS. Circ Arrhythm Electrophysiol. août 2009;2(4):450‑9.
14. Huang Z, Zheng Z, Luo Y, Li S, Zhu J, Liu J. Prevalence of sleep-disordered breathing in acute coronary syndrome: a systemic review and meta-analysis. Sleep Breath Schlaf Atm. mars 2017;21(1):217‑26.
15. Arzt M, Oldenburg O, Graml A, Schnepf J, Erdmann E, Teschler H, et al. Prevalence and predictors of sleep-disordered breathing in chronic heart failure: the SchlaHF-XT registry. ESC Heart Fail. déc 2022;9(6):4100‑11.
16. Xie C, Zhu R, Tian Y, Wang K. Association of obstructive sleep apnoea with the risk of vascular outcomes and all-cause mortality: a meta-analysis. BMJ Open. 22 déc 2017;7(12):e013983.
17. Chouchou F, Pichot V, Barthélémy JC, Bastuji H, Roche F. Cardiac sympathetic modulation in response to apneas/hypopneas through heart rate variability analysis. PloS One. 2014;9(1):e86434.
18. Abboud FM. The Walter B. Cannon Memorial Award Lecture, 2009. Physiology in perspective: The wisdom of the body. In search of autonomic balance: the good, the bad, and the ugly. Am J Physiol Regul Integr Comp Physiol. juin 2010;298(6):R1449-1467.
19. Jelic S, Le Jemtel TH. Inflammation, Oxidative Stress, and the Vascular Endothelium in Obstructive Sleep Apnea. Trends Cardiovasc Med. 1 oct 2008;18(7):253‑60.
20. Arnaud C, Poulain L, Lévy P, Dematteis M. Inflammation contributes to the atherogenic role of intermittent hypoxia in apolipoprotein-E knock out mice. Atherosclerosis. déc 2011;219(2):425‑31.
21. Meslier N, Gagnadoux F, Giraud P, Person C, Ouksel H, Urban T, et al. Impaired glucose-insulin metabolism in males with obstructive sleep apnoea syndrome. Eur Respir J. juill 2003;22(1):156‑60.
22. Drager L, Polotsky V. Lipid Metabolism: A New Frontier in Sleep Apnea Research. Am J Respir Crit Care Med. 1 août 2011;184(3):288‑90.
23. Kent BD, McNicholas WT, Ryan S. Insulin resistance, glucose intolerance and diabetes mellitus in obstructive sleep apnoea. J Thorac Dis. août 2015;7(8):1343‑57.
24. Réseau Morphée [Internet]. [cité 11 avr 2024]. Les examens du sommeil. Disponible sur: https://reseau-morphee.fr/le-sommeil-et-ses-troubles-informations/comment-explorer-le-sommeil
25. Marin JM, Carrizo SJ, Vicente E, Agusti AGN. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet Lond Engl. 19 mars 2005;365(9464):1046‑53.
26. Kendzerska T, Gershon AS, Hawker G, Leung RS, Tomlinson G. Obstructive sleep apnea and risk of cardiovascular events and all-cause mortality: a decade-long historical cohort study. PLoS Med. févr 2014;11(2):e1001599.
27. Sforza E, Gauthier M, Crawford-Achour E, Pichot V, Maudoux D, Barthélémy JC, et al. A 3-year longitudinal study of sleep disordered breathing in the elderly. Eur Respir J. 1 sept 2012;40(3):665‑72.
28. Sforza E, Sabri M, DaCosta A, Isaaz K, Barthélémy JC, Roche F. Echocardiographic Findings in Healthy Elderly People with Unrecognized Sleep Disordered Breathing. J Clin Sleep Med JCSM Off Publ Am Acad Sleep Med. 15 sept 2015;11(9):975‑80.
29. Gunnarsson SI, Peppard PE, Korcarz CE, Barnet JH, Aeschlimann SE, Hagen EW, et al. Obstructive sleep apnea is associated with future subclinical carotid artery disease: thirteen-year follow-up from the Wisconsin sleep cohort. Arterioscler Thromb Vasc Biol. oct 2014;34(10):2338‑42.
30. Trzepizur W, Blanchard M, Ganem T, Balusson F, Feuilloy M, Girault JM, et al. Sleep Apnea-Specific Hypoxic Burden, Symptom Subtypes, and Risk of Cardiovascular Events and All-Cause Mortality. Am J Respir Crit Care Med. 1 janv 2022;205(1):108‑17.
31. Azarbarzin A, Sands SA, Stone KL, Taranto-Montemurro L, Messineo L, Terrill PI, et al. The hypoxic burden of sleep apnoea predicts cardiovascular disease-related mortality: the Osteoporotic Fractures in Men Study and the Sleep Heart Health Study. Eur Heart J. 7 avr 2019;40(14):1149‑57.
32. Gami AS, Olson EJ, Shen WK, Wright RS, Ballman KV, Hodge DO, et al. Obstructive sleep apnea and the risk of sudden cardiac death: a longitudinal study of 10,701 adults. J Am Coll Cardiol. 13 août 2013;62(7):610‑6.
33. Hirotsu C, Betta M, Bernardi G, Marques-Vidal P, Vollenweider P, Waeber G, et al. Pulse wave amplitude drops during sleep: clinical significance and characteristics in a general population sample. Sleep. 13 juill 2020;43(7):zsz322.
34. Solelhac G, Sánchez-de-la-Torre M, Blanchard M, Berger M, Hirotsu C, Imler T, et al. Pulse Wave Amplitude Drops Index: A Biomarker of Cardiovascular Risk in Obstructive Sleep Apnea. Am J Respir Crit Care Med. 15 juin 2023;207(12):1620‑32.
35. Azarbarzin A, Sands SA, Younes M, Taranto-Montemurro L, Sofer T, Vena D, et al. The Sleep Apnea-Specific Pulse-Rate Response Predicts Cardiovascular Morbidity and Mortality. Am J Respir Crit Care Med. 15 juin 2021;203(12):1546‑55.
36. Bock J, Covassin N, Somers V. Excessive daytime sleepiness: an emerging marker of cardiovascular risk. Heart Br Card Soc. 28 oct 2022;108(22):1761‑6.
37. Xie J, Sert Kuniyoshi FH, Covassin N, Singh P, Gami AS, Chahal CAA, et al. Excessive Daytime Sleepiness Independently Predicts Increased Cardiovascular Risk After Myocardial Infarction. J Am Heart Assoc. 19 janv 2018;7(2):e007221.
38. Lombardi C, Parati G, Cortelli P, Provini F, Vetrugno R, Plazzi G, et al. Daytime sleepiness and neural cardiac modulation in sleep-related breathing disorders. J Sleep Res. sept 2008;17(3):263‑70.
39. Haute Autorité de Santé [Internet]. [cité 11 avr 2024]. Apnées du sommeil : de nouvelles recommandations de prise en charge des patients. Disponible sur: https://www.has-sante.fr/jcms/c_1761160/fr/apnees-du-sommeil-de-nouvelles-recommandations-de-prise-en-charge-des-patients
40. Portier F, Orvoen Frija E, Chavaillon JM, Lerousseau L, Reybet Degat O, Léger D, et al. Traitement du SAHOS par ventilation en pression positive continue (PPC). Rev Mal Respir. oct 2010;27:S137‑45.
41. Fleury B, Cohen-Levy J, Lacassagne L, Buchet I, Geraads A, Pegliasco H, et al. Traitement du SAHOS par orthèse d’avancée mandibulaire (OAM). Rev Mal Respir. oct 2010;27:S146‑56.
42. Blumen M, Crampette L, Fischler M, Galet De Santerre O, Jaber S, Larzul JJ, et al. Traitement chirurgical du SAHOS. Rev Mal Respir. oct 2010;27:S157‑65.
43. Vecchierini MF, Laaban JP, Desjobert M, Gagnadoux F, Chabolle F, Meurice JC, et al. Stratégie thérapeutique du SAHOS intégrant les traitements associés ? Rev Mal Respir. oct 2010;27:S166‑78.
44. Pépin JL, Bailly S, Rinder P, Adler D, Benjafield AV, Lavergne F, et al. Relationship Between CPAP Termination and All-Cause Mortality: A French Nationwide Database Analysis. Chest. juin 2022;161(6):1657‑65.
45. Gervès-Pinquié C, Bailly S, Goupil F, Pigeanne T, Launois S, Leclair-Visonneau L, et al. Positive Airway Pressure Adherence, Mortality, and Cardiovascular Events in Patients with Sleep Apnea. Am J Respir Crit Care Med. 1 déc 2022;206(11):1393‑404.
46. Anandam A, Patil M, Akinnusi M, Jaoude P, El-Solh AA. Cardiovascular mortality in obstructive sleep apnoea treated with continuous positive airway pressure or oral appliance: an observational study. Respirol Carlton Vic. nov 2013;18(8):1184‑90.
47. de Vries GE, Wijkstra PJ, Houwerzijl EJ, Kerstjens HAM, Hoekema A. Cardiovascular effects of oral appliance therapy in obstructive sleep apnea: A systematic review and meta-analysis. Sleep Med Rev. août 2018;40:55‑68.
48. Yeghiazarians Y, Jneid H, Tietjens JR, Redline S, Brown DL, El-Sherif N, et al. Obstructive Sleep Apnea and Cardiovascular Disease: A Scientific Statement From the American Heart Association. Circulation. 20 juill 2021;144(3):e56‑67.
49. Labarca G, Schmidt A, Dreyse J, Jorquera J, Enos D, Torres G, et al. Efficacy of continuous positive airway pressure (CPAP) in patients with obstructive sleep apnea (OSA) and resistant hypertension (RH): Systematic review and meta-analysis. Sleep Med Rev. août 2021;58:101446.
50. Ben-Dov IZ, Kark JD, Ben-Ishay D, Mekler J, Ben-Arie L, Bursztyn M. Predictors of all-cause mortality in clinical ambulatory monitoring: unique aspects of blood pressure during sleep. Hypertens Dallas Tex 1979. juin 2007;49(6):1235‑41.
51. Navarro-Soriano C, Martínez-García MA, Torres G, Barbé F, Caballero-Eraso C, Lloberes P, et al. Effect of continuous positive airway pressure in patients with true refractory hypertension and sleep apnea: a post-hoc intention-to-treat analysis of the HIPARCO randomized clinical trial. J Hypertens. juin 2019;37(6):1269‑75.
52. Anter E, Di Biase L, Contreras-Valdes FM, Gianni C, Mohanty S, Tschabrunn CM, et al. Atrial Substrate and Triggers of Paroxysmal Atrial Fibrillation in Patients With Obstructive Sleep Apnea. Circ Arrhythm Electrophysiol. nov 2017;10(11):e005407.
53. Monahan K, Brewster J, Wang L, Parvez B, Goyal S, Roden DM, et al. Relation of the severity of obstructive sleep apnea in response to anti-arrhythmic drugs in patients with atrial fibrillation or atrial flutter. Am J Cardiol. 1 août 2012;110(3):369‑72.
54. Nalliah CJ, Wong GR, Lee G, Voskoboinik A, Kee K, Goldin J, et al. Impact of CPAP on the Atrial Fibrillation Substrate in Obstructive Sleep Apnea: The SLEEP-AF Study. JACC Clin Electrophysiol. juill 2022;8(7):869‑77.
55. Lee CH, Sethi R, Li R, Ho HH, Hein T, Jim MH, et al. Obstructive Sleep Apnea and Cardiovascular Events After Percutaneous Coronary Intervention. Circulation. 24 mai 2016;133(21):2008‑17.
56. Sánchez-de-la-Torre M, Gracia-Lavedan E, Benitez ID, Sánchez-de-la-Torre A, Moncusí-Moix A, Torres G, et al. Adherence to CPAP Treatment and the Risk of Recurrent Cardiovascular Events: A Meta-Analysis. JAMA. 3 oct 2023;330(13):1255‑65.
57. Pinilla L, Esmaeili N, Labarca G, Martinez-Garcia MÁ, Torres G, Gracia-Lavedan E, et al. Hypoxic burden to guide CPAP treatment allocation in patients with obstructive sleep apnoea: a post hoc study of the ISAACC trial. Eur Respir J. déc 2023;62(6):2300828.
58. Azarbarzin A, Zinchuk A, Wellman A, Labarca G, Vena D, Gell L, et al. Cardiovascular Benefit of Continuous Positive Airway Pressure in Adults with Coronary Artery Disease and Obstructive Sleep Apnea without Excessive Sleepiness. Am J Respir Crit Care Med. 15 sept 2022;206(6):767‑74.
59. Kidawara Y, Kadoya M, Morimoto A, Daimon T, Kakutani-Hatayama M, Kosaka-Hamamoto K, et al. Sleep Apnea and Physical Movement During Sleep, But Not Sleep Duration, Are Independently Associated With Progression of Left Ventricular Diastolic Dysfunction: Prospective Hyogo Sleep Cardio-Autonomic Atherosclerosis Cohort Study. J Am Heart Assoc. 4 oct 2022;11(19):e024948.
60. Khayat RN, Porter K, Germany RE, McKane SW, Healy W, Randerath W. Clinical and financial impact of sleep disordered breathing on heart failure admissions. Sleep Breath Schlaf Atm. oct 2023;27(5):1917‑24.
61. Oldenburg O, Wellmann B, Buchholz A, Bitter T, Fox H, Thiem U, et al. Nocturnal hypoxaemia is associated with increased mortality in stable heart failure patients. Eur Heart J. 1 juin 2016;37(21):1695‑703.
62. Jaffuel D, Philippe C, Rabec C, Mallet JP, Georges M, Redolfi S, et al. What is the remaining status of adaptive servo-ventilation? The results of a real-life multicenter study (OTRLASV-study). Respir Res. 29 oct 2019;20(1):235.
63. Jaffuel D, Philippe C, D’Ortho MP, Bironneau V, Perrin C, Redolfi S, et al. Consensus français sur les syndromes d’apnées et hypopnées centrales du sommeil (SAHCS) de l’adulte. Partie 3 : prise en charge thérapeutique. Médecine Sommeil [Internet]. 29 févr 2024 [cité 12 avr 2024]; Disponible sur: https://www.sciencedirect.com/science/article/pii/S1769449323005393
64. Caravita S, Faini A, Vignati C, Pelucchi S, Salvioni E, Cattadori G, et al. Intravenous iron therapy improves the hypercapnic ventilatory response and sleep disordered breathing in chronic heart failure. Eur J Heart Fail. oct 2022;24(10):1940‑9.
65. Jaffuel D, Nogue E, Berdague P, Galinier M, Fournier P, Dupuis M, et al. Sacubitril-valsartan initiation in chronic heart failure patients impacts sleep apnea: the ENTRESTO-SAS study. ESC Heart Fail. août 2021;8(4):2513‑26.
66. Jaffuel D, Bouchaut Y, Mallet JP, Vidal C, Molinari N, Bourdin A, et al. Dapagliflozin initiation in chronic heart failure patients improves central sleep apnoea. ERJ Open Res. mai 2023;9(3):00123‑2023.
67. Bradley TD, Logan AG, Kimoff RJ, Sériès F, Morrison D, Ferguson K, et al. Continuous positive airway pressure for central sleep apnea and heart failure. N Engl J Med. 10 nov 2005;353(19):2025‑33.
68. Naito R, Kasai T, Tomita Y, Kasagi S, Narui K, Momomura SI. Clinical outcomes of chronic heart failure patients with unsuppressed sleep apnea by positive airway pressure therapy. Front Cardiovasc Med. 2023;10:1156353.
69. Bradley TD, Floras JS, ADVENT-HF Investigators. The SERVE-HF Trial. Can Respir J. 2015;22(6):313.
70. Tamisier R, Damy T, Bailly S, Goutorbe F, Davy JM, Lavergne F, et al. FACE study: 2-year follow-up of adaptive servo-ventilation for sleep-disordered breathing in a chronic heart failure cohort. Sleep Med. janv 2024;113:412‑21.
71. Karimi M, Hedner J, Grote L. Changes in cognitive function and daytime sleepiness in patients with chronic heart failure and Cheyne-Stokes respiration with adaptive servo ventilation treatment. Sleep Med. juill 2023;107:157‑63.
Vous devez être connecté pour poster un commentaire
