Les complications en stimulation cardiaque
Florence Nicolas et Nathalie Beauplet Marhic, Infirmières en rythmologie interventionnelle et télécardiologie, CHU de Nantes
Septembre 2023
Le risque zéro n’existe pas. L’implantation de prothèses cardiaques n’y fait pas exception. Même si l’on aimerait tendre vers la perfection, des grains de sable viennent parfois contrarier les rouages. A chaque stade correspond un lot de complications, plus au moins graves. Elles concernent environ 10% des interventions. Nous les aborderons ici dans l’ordre chronologique de leurs éventuelles apparitions.
Ces complications doivent être parfaitement connues par les équipes soignantes afin de pouvoir les prévenir, savoir les diagnostiquer et adapter leur prise en charge. Il existe bien évidemment un facteur lié à l’expérience des équipes dans la réalisation de ces procédures, il est prouvé que les centres à haut volume d’implantation ont des taux de complication moins importants.
Nous allons donc passer en revue les principales complications rencontrées dans le domaine de la stimulation cardiaque et les principes de prise en charge de celles-ci. Le tableau ci-dessous résume les complications possibles, elles peuvent être classées en complications communes à toutes les procédures d’implantation, comme les complications de la voie d’abord, le risque infectieux ou hémorragiques, il peut exister en revanche des complications spécifiques à certaines procédures.
|
Incidence des complications après implantation de stimulateur cardiaque |
% |
|
Toute complication |
5–15 |
|
Mortalité (<30 jours) |
0,8–1,4 |
|
Réintervention liée à la sonde (dont déplacement, malposition, syndrome de compression sous-clavier, etc.) |
1.0–5.9 |
|
Infection précoce <12 mois |
0,7–1,7 |
|
Infection superficielle |
1.2 |
|
Infection de la loge |
0,4 |
|
Infection systémique |
0,5 |
|
Infection tardive > 12 mois |
1.1–4.6 |
|
Infection de la loge |
1.3 |
|
Infection systémique |
0,5–1,2 |
|
Pneumothorax |
0,5–2,2 |
|
Hémothorax |
0,1 |
|
Lésion du plexus brachial |
<0,1 |
|
Perforation cardiaque |
0,3–0,7 |
|
Dissection/perforation du sinus coronaire |
0,7–2,1 |
|
Révision due à la douleur/l'inconfort |
0,1–0,4 |
|
Stimulation diaphragmatique nécessitant une réintervention |
0,5–5 |
|
Hématome |
2.1–5.3 |
|
Insuffisance tricuspide |
5–15 |
|
Syndrome du stimulateur cardiaque |
1–20 |
|
Dysfonction de boitier /sonde |
0,1–1,5 |
|
Thrombose veineuse profonde (aiguë ou chronique) |
0,1–2,6 |
En premier lieu, il est important de prendre en compte le stress lié à l’intervention. Pour l’équipe de soins, la salle d’intervention est un environnement familier. Ce n’est pas le cas pour le patient qui doit affronter la douleur, le stress, la nudité, l’inconfort d’un environnement confiné et climatisé, la complexité du matériel de bloc, la soif provoquée par l’anxiété et la diète, le tout entouré d’une équipe donc les visages sont cachés par masques et calots. Pour cette raison, avant même son arrivée sur le plateau technique en implantation, le parcours du patient a été pensé pour optimiser son confort et la fluidité des soins. L’accueil se doit d’être clair et rassurant dans une ambiance conviviale. L’installation est confortable. Une explication factuelle aide à instaurer un climat de confiance. Cette prise en charge est en constante évolution. Depuis quelques années, à Nantes, il est proposé aux patients (en complément de la prémédication) un fond musical, un casque de réalité virtuelle ou de la sédation. Plus le patient sera intégré dans son parcours de santé, mieux l’intervention sera tolérée.
Au cours de l’intervention, les premiers gestes à risque de complication sont les ponctions. Les recommandations (1) sont de privilégier les abords céphaliques et axillaires à moindre risque de pneumothorax et surtout d’être attentif aux images radiologiques. Les pneumothorax sont toutefois exceptionnels et les drainages sont peu fréquents. Les autres facteurs de risque de survenue d’un pneumothorax sont l’âge > 80 ans, le sexe féminin, l’antécédent de BPCO et l’index de masse corporelle (IMC) bas. La survenue d’un pneumothorax incomplet peut être traité sans drainage, une surveillance radiologique jusqu’au recollement du poumon est recommandée.
Pour positionner les sondes, il est recommandé d’éviter les parois libres du cœur (1) afin d’éviter qu'une sonde soit transfixiante ou la formation d'un hémopéricarde. Une fois les positionnements de sondes optimisés et les valeurs de seuil validées restent encore à les raccorder correctement au dispositif implantable. L’inversion des connectiques et les défauts de vissage sont des fautes d’inattention mais bien peu d’implanteurs peuvent affirmer y échapper dans leur pratique, même parmi les plus expérimentés.
Une sonde transfixiante peu mener à la tamponnade cardiaque ou l’hémothorax. Les facteurs de risque sont l’âge avancé, l’index de masse corporelle < 20, le sexe féminin, un traitement par antiagrégants plaquettaires ou corticoïdes, la position de la sonde en paroi latérale pour l’OD et l’apex pour le VD. La tamponnade peropératoire est une urgence thérapeutique, les équipes doivent être entrainées à établir un diagnostique rapide en réalisant une échocardiographie sur table et pouvoir drainer l’épanchement par ponction sous xiphoïdienne, il est recommandé d’avoir un kit de drainage prêt à l’emploi.
Il n’est pas rare d’observer la survenue d’un épanchement péricardique en post implantation, dans une étude incluant 968 patients ayant eu un échocardiogramme réalisé systématiquement avant et moins de 24 h après l'implantation du CIED, un nouvel épanchement péricardique léger (<_10 mm en diastole) a été retrouvé chez jusqu'à 8,3 % des patients, avec une atteinte modérée (11-20 mm) et importante (> 20 mm) chez 0,4 % et 1,5 % des patients, respectivement.
Les épanchements sont asymptomatiques chez 94 % des patients, si une douleur d’irritation péricarditique est constatée, un traitement par anti-inflammatoire type Colchimax est en général prescrit.
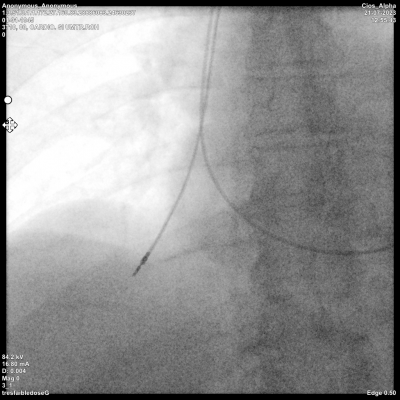
Sonde transfixiante
Le déplacement de sonde est un risque fréquent rapporté dans 1,2 à 3,3 % des implantations.. Il survient généralement précocément en fin d’intervention, lors du contrôle avec le programmateur ou par la radiographie. Une reprise de l'intervention est alors nécessaire. Il concerne particulièrement les sondes ventriculaires gauches car elles ne sont pas vissées dans la cavité cardiaque.
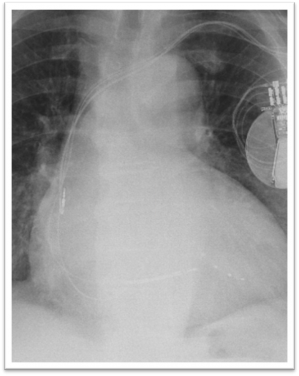
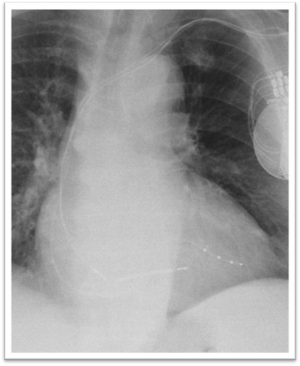
Déplacement de la sonde atriale
Le risque d'hématome de loge doit aussi être pris en compte.
Il s'agit d'une complication fréquente (2,1 à 9,5 % selon les séries), entrainant une durée d’hospitalisation plus longue et un excès de risque en terme de mortalité hospitalière (2,0 % contre 0,7 %). L’hématome de loge est un facteur de risque infectieux important, multipliant par 7 le risque de survenue d’une infection du matériel implanté.
En général, la prise en charge conservatrice est possible. L'évacuation, nécessaire dans 0,3 à 2 % des cas, est indiquée en cas de déhiscence de la cicatrice ou d'érosion cutanée, de douleur intense, d’œdème du bras, de lésion du plexus brachial ou d'atteinte artérielle. L’évacuation chirurgicale est associée à un risque d'infection encore plus important (risque multiplié par 15).
Les patients sous traitement anti-thrombotique ou ACO y sont les plus exposés. On parle ici de saignements de loge per-procédure, d’ecchymoses et d’hématomes. Pour l’anticiper, la vérification du bilan biologique est indispensable. Elle est du ressort de l’équipe. En cas de bilan perturbé, notamment sur l'INR et les plaquettes, l’intervention peut être reportée. Il peut être posé un pansement compressif en sortie de salle. Une surveillance locale rigoureuse par un(e) infirmier/ère du service de soins est indispensable. Il faut alors être particulièrement vigilant car un saignement actif peut être source de complications et parfois imposer une reprise chirurgicale rapprochée.
Présent à la fois au cours de l'intervention et dans les semaines qui suivent, l'infection est un risque majeur qui nécessite un respect stricte des règles d'hygiène et d'asepsie pendant la procédure, une antibioprophylaxie, une préparation cutanée optimale.
Il existe des facteurs de risque pouvant favoriser l'infection (figure) : ceux liés au patient, à la procédure et enfin ceux liés au matériel implanté.
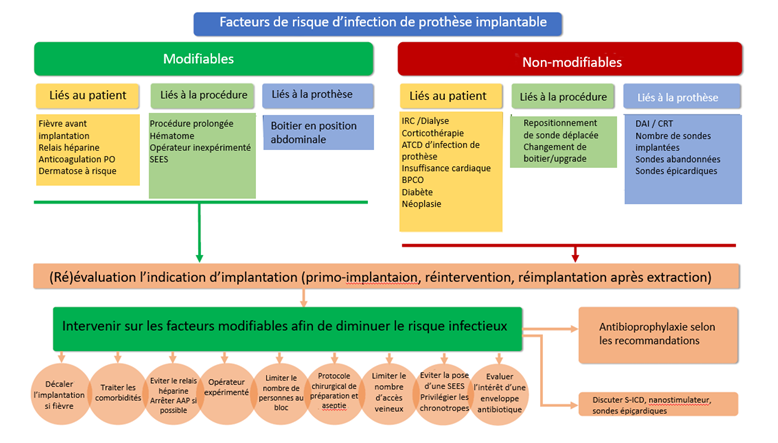
Facteurs de risque d’infection et mesures préventives (adapté à partir de Blomström-Lundqvist et al )
BPCO : bronchopneumopathie chronique obstructive, CRT : thérapie de resynchronisation cardiaque, DAI : défibrillateur automatique implantable, IRC : insuffisance rénale chronique, PO : per os, SEES : sonde d’entrainement électro systolique
Les points d’alerte sont la survenue d’une fièvre et une cicatrice qui présente une rougeur, un gonflement, une sensation de chaleur, la persistance de la douleur au-delà de 5 à 10 jour ou un écoulement de désunion. Le risque est alors l’endocardite avec pour conséquence l’extraction de tout le matériel, sondes et boîtier, en salle technique ou au bloc de chirurgie cardiaque si le matériel est plus ancien. Afin de minimiser ce risque infectieux, on administre un antibiotique 1 heure avant le début de la procédure. Il s’agit de 2 grammes de céfazoline ou, pour les patients allergiques de 1 gramme de vancomycine. Si l’intervention doit être amenée à se prolonger au-delà de 4 heures après cette injection, il faut renouveler la céfazoline. Il est possible de mettre en place dans la loge du boîtier une enveloppe antibactérienne résorbable, qui va libérer de la rifampicine et de la minocycline. Cette enveloppe antibactérienne est recommandée uniquement pour les changements de boîtier et les primo- implantations de CRT-D, procédures à plus fort risque infectieux. Il est à noter que le risque d’endocardite persiste au cours des années, sans lien cette fois avec la cicatrisation mais à l’occasion d’une autre infection, notamment d’origine dentaire. Le patient doit en être conscient et rester acteur de son parcours de soin.
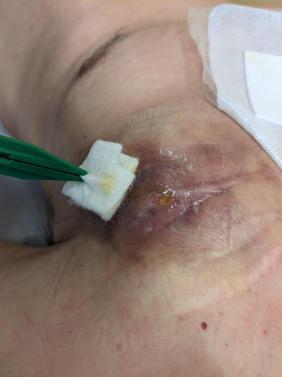
Au long cours, le port d’un dispositif implantable peut aussi entraîner des gênes et des douleurs. Elles concernent entre autres la mobilité de l’épaule et du bras ainsi que l’habillage (soutien-gorge). La perception de son image corporelle, altérée par cette « protubérance » est, pour certains, difficile à accepter même après plusieurs années.
Enfin, une défaillance du matériel peut survenir au long cours. Il faut savoir qu’avec les années et la mobilité incessante des bras, les sondes peuvent se fracturer. On parle ici de rupture du conducteur ou de l’isolant. Ce risque est majoré chez les sportifs dont la pratique soutenue sollicite intensément les bras (crawl, aviron, tir à l’arc, golf, etc..). Le boîtier peut aussi se déplacer et entraîner la gêne et l’inconfort. Chez d’autres patients, avec l’âge et/ou la maladie, la modification de corpulence liée à perte de muscle ou à la dénutrition peut provoquer l’extériorisation du boîtier. Il faut alors prévoir un remplacement du matériel endommagé et donc une nouvelle prise en charge interventionnelle.
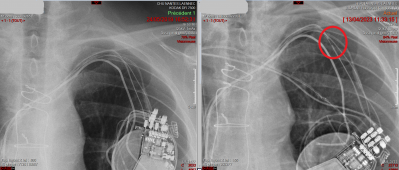
Fracture de sonde
Nous n’avons pas abordé ici les complications liées à une défaillance du matériel qu’elle soit liée à un défaut de conception ou de fabrication. De même, nous n’avons pas abordé les défauts d’optimisation des paramètres des pacemakers et défibrillateurs et leurs conséquences : efficacité limitée du dispositif implantable, chocs inappropriés, usure prématurée de la batterie…
Pour un dépistage précoce des complications, un contrôle régulier des stimulateurs et défibrillateurs est indispensable. Il peut s’agir d’un contrôle en consultation d’une périodicité annuelle ou plus rapprochée selon le patient ou via la télésurveillance à un rythme quasi-quotidien. Dorénavant, dans le cadre d’un protocole de coopération, certains d’entre nous participent activement à cette télésurveillance. A nous de promouvoir et de développer ces activités au sein de nos centres pour assurer aux porteurs de stimulateurs et défibrillateurs le meilleur des mondes possible.
Référence
1. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA), European Heart Journal, Volume 42, Issue 35, 14 September 2021, Pages 3427–3520, https://doi.org/10.1093/eurheartj/ehab364
Vous devez être connecté pour poster un commentaire
