Les cardiopathies pédiatriques non cyanogènes
Mélanie GIRAULT et Aurélie TURBIN IDE de Consultation du service médico-chirurgicale de cardiologie pédiatrique – NECKER ENFANTS MALADES
En collaboration avec le Dr Diala KHRAICHE et le DR Régis GAUDIN.
Le 17 Novembre 2023,
Les Cardiopathie congénitales sont fréquentes, elles représentent 1 % des naissances. Dans ces dernières, on distingue les cardiopathies cyanogènes (saturation basse dans l’aorte non due à une pathologie pulmonaire) et les cardiopathies non cyanogènes.
Les principales cardiopathies congénitales non cyanogènes :
1- Des défauts de septation c’est-à-dire de cloisonnements intra cardiaque: Communication inter auriculaire (CIA), Communication inter ventriculaire (CIV)
2- Canal atrio-ventriculaire (CAV)
3- Persistance du canal artériel
4- Obstacle à l’éjection du cœur gauche ou droit : Coarctation de l’aorte, rétrécissement aortique, sténose pulmonaire.
5- Cardiomyopathies.
1- Défaut de septation
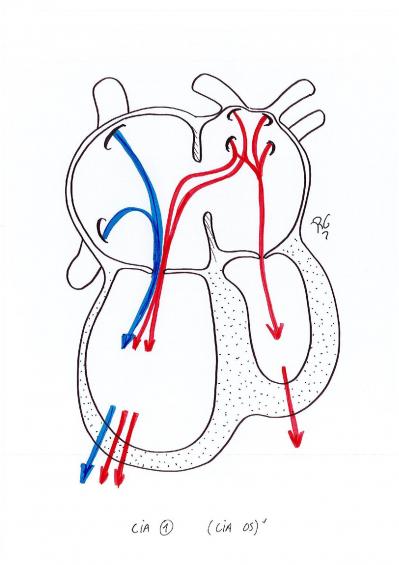
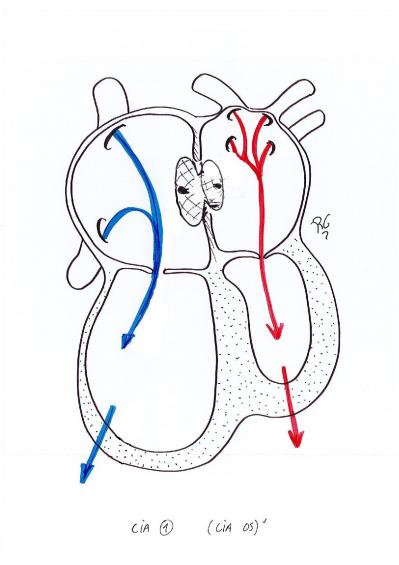
Communication inter auriculaire : CIA
Il s’agit d’un défaut du cloisonnement au niveau du septum inter auriculaire qui se manifeste par une communication entre le sang de l’oreillette gauche qui va se mélanger avec le sang dans l’oreillette droite et qui a pour conséquence une dilatation du ventricule droit et un hyperdébit pulmonaire.
Sur le plan clinique on entend à l’auscultation un souffle dû à l’hyperdébit à travers la valve pulmonaire mais le plus souvent le patient ne ressent aucun symptôme.
Lorsque l’hyperdébit pulmonaire est important, cela peut entrainer à l’âge adulte une Hypertension des artères pulmonaires (HTAP).
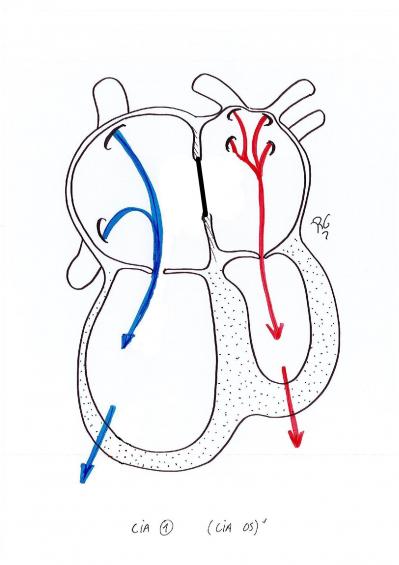
Le traitement consiste à fermer cette communication soit chirurgicalement à l’aide d’un patch soit par voie percutanée à l’aide d’une prothèse.
Communication inter ventriculaire : CIV
Il s’agit d’un défaut du cloisonnement au niveau du septum inter ventriculaire qui se manifeste par une communication entre le sang du ventricule gauche qui va se mélanger avec le sang du ventricule droit et qui a pour conséquence une dilatation du ventricule gauche et un hyperdébit pulmonaire.
Sur le plan clinique on entend à l’auscultation un souffle dû à l’hyperdébit à travers la valve pulmonaire. Le patient peut être symptomatique (surtout entre 1 mois et 1 an) : polypnée, tachycardie, mauvaise prise pondérale liée à des difficultés d’alimentation chez les bébés, une susceptibilité aux infections respiratoires avec des risques plus importants de décompensation et d’hospitalisation.
Lorsque la communication est très large (égalisation des pressions entre les deux ventricules et/ou si l’hyperdébit pulmonaire est important, cela peut entrainer une hypertension des artères pulmonaires (HTAP) beaucoup plus précocement que les CIA.
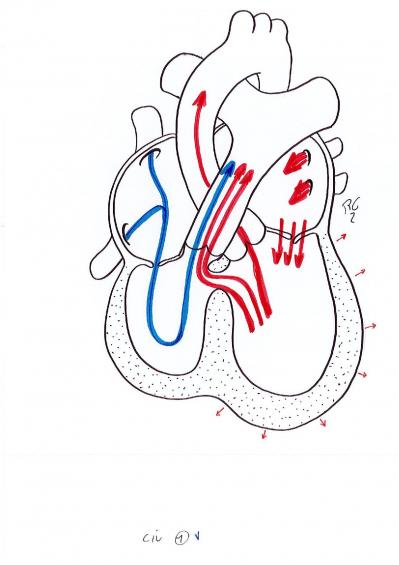
Le traitement consiste à fermer cette communication le plus souvent par voie chirurgicale.
Avant la chirurgie en cas de CIV importante, une transfusion peut être réalisée afin d’augmenter la viscosité du sang et limiter l’hyperdébit et ses conséquences délétères sur la santé de l’enfant. Une prophylaxie des bronchiolites à VRS (injection d’immunoglobulines) chez les nourrissons de <1 an est très importante et permet d’éviter une partie des hospitalisations dues à ces viroses respiratoires.
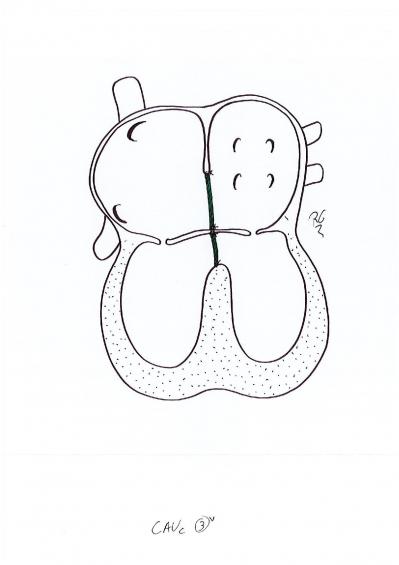
2- Canal atrio-ventriculaire : CAV
C’est une anomalie congénitale avec la persistance d’une valve auriculo ventriculaire unique associées à une CIA et CIV. Cette malformation est souvent associée à la trisomie 21 ou autre syndromes. Elle est souvent diagnostiquée en anténatal.
Les symptômes sont similaires à la CIV.
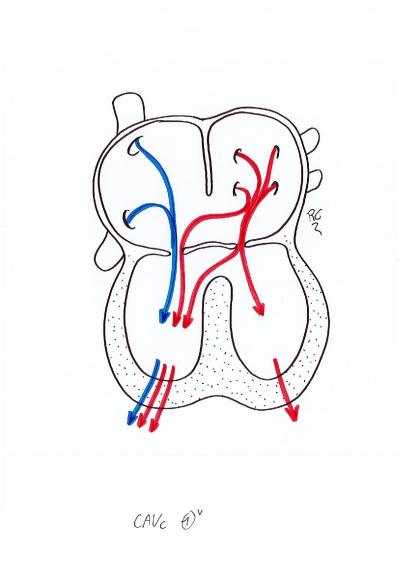
Le traitement consiste en une chirurgie à cœur ouvert entre 3 et 6 mois.
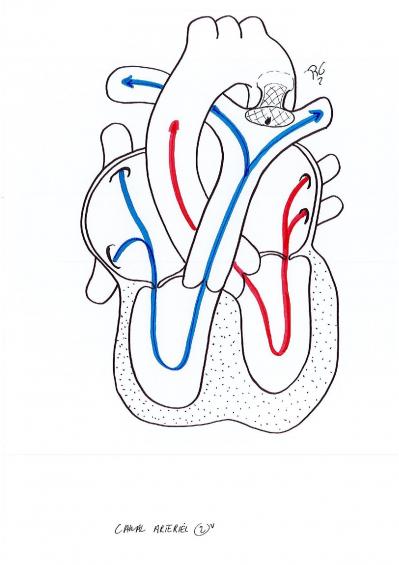
3- Persistance du canal artériel
Pendant la vie fœtale, un canal est présent entre l’artère pulmonaire et l’aorte permettant de shunter la circulation pulmonaire puisque les poumons ne participent pas à l’hématose (oxygénation du sang). Pendant cette période peu de sang circule dans les artères pulmonaires et donc la majeure partie retourne dans l’aorte à travers le canal. Ce canal se ferme habituellement dans les premiers jours de vie lorsque la saturation augmente et entraine sa fermeture. Il peut persister dans certains cas : prématurité, trisomie 21 mais également chez des enfants sans cardiopathies ni syndrome génétique. Dans ce cas, le sang de l’aorte est aspiré vers les poumons à travers ce canal. Cela entraine un hyperdébit pulmonaire.
La clinique et les symptômes sont similaires à ceux de la CIV.
La prise en charge dépend de sa taille et de l’importance de l’hyperdébit pulmonaire.
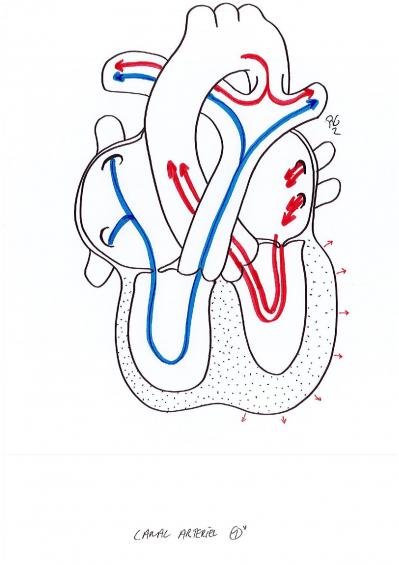
Lorsque le canal artériel est très large (égalisation des pressions entre l’aorte et l’artère pulmonaire) ou si l’hyperdébit pulmonaire est important, on peut le fermer par cathétérisme (pose d’une prothèse) ou par chirurgie s’il est trop large (ligature section).

4- Obstacle à l’éjection du cœur gauche ou droit
La coarctation de l’aorte
C’est un rétrécissement au niveau de l’isthme de l’aorte (en regard du canal artériel, en amont de la naissance de l’artère sous clavière gauche) qui apparait après la naissance à la fermeture du cana artériel. Cela entraine un obstacle à l’éjection du ventricule gauche (augmentation de la pression dans le ventricule) et donc un travail plus important. Il y a alors un risque de développer une insuffisance cardiaque surtout chez les enfants de <1 mois.
Les symptômes sont l’absence de pouls fémoraux (au pli de l’aine) et un gradient tensionnel entre le membre supérieur droit et le membre supérieur et les membres inférieurs. La coarctation de l’aorte peut également être révélée par des signes d’insuffisance cardiaque (polypnée, mauvaise prise pondérale, pâleur cutanée, tachycardie).
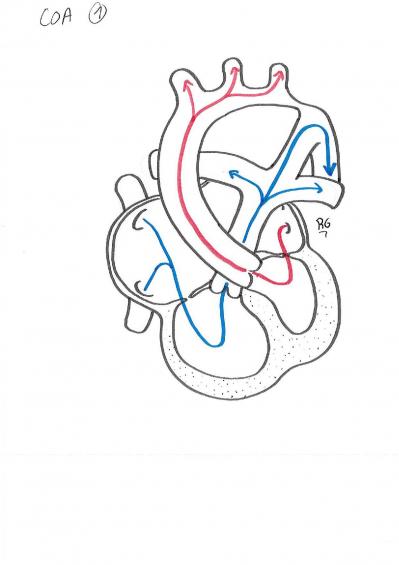
En pré-opératoire pour les nouveaux nés symptomatique, une perfusion de prostaglandine est administrée. Elle permet de maintenir le canal artériel large afin de limiter les effets de la coarctation, en attendant la chirurgie.
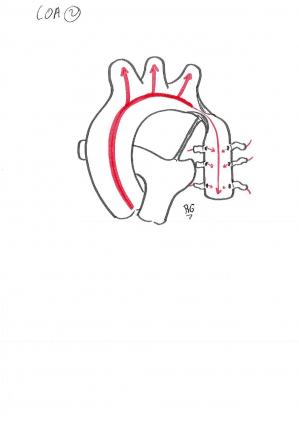
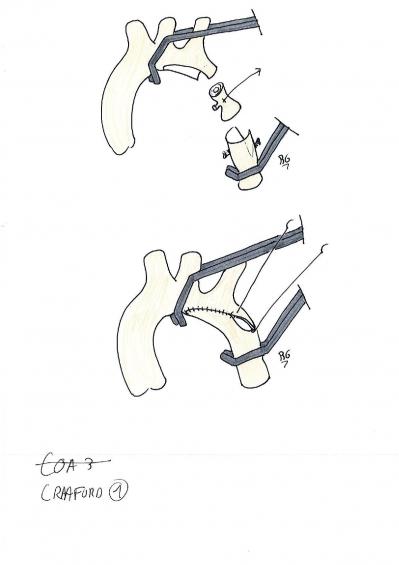
Le traitement consiste en une chirurgie de plastie de l’aorte ou un traitement par cathétérisme chez les enfants plus âgé ou les adultes (dilatation et pose de stent).
Le rétrécissement aortique
C’est un obstacle au niveau de la valve aortique qui constitue un obstacle à l’éjection du ventricule gauche.
Il est le plus souvent symptomatique chez les plus petits enfants (nouveaux nés ou nourrissons).
Chez les plus grands enfants, il y a le plus souvent pas de symptômes sauf lorsqu’il devient important (notamment à la puberté). Après plusieurs années, selon l’évolution du rétrécissement, le patient peut faire des syncopes, des dyspnées d’effort, de l’insuffisance cardiaque et/ou des troubles du rythme.
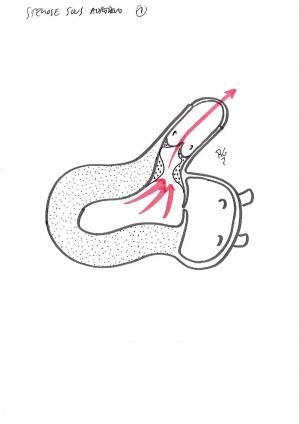
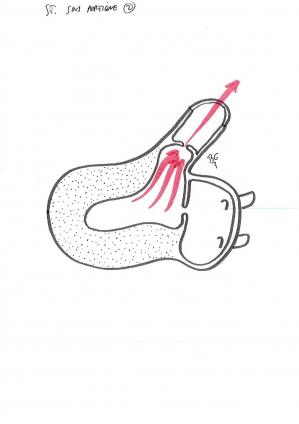
On traite les patients symptomatiques par chirurgie cardiaque (plastie ou un remplacement valvulaire) ou par cathétérisme cardiaque (dilatation par ballonnet).
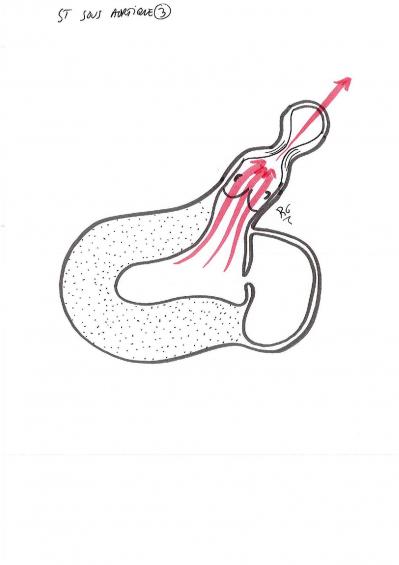
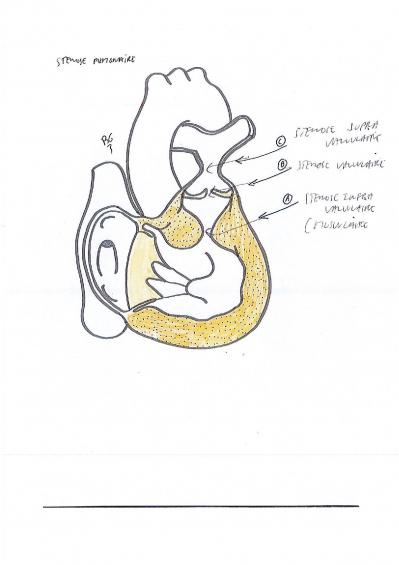
La sténose pulmonaire
C’est un rétrécissement qui se situe au niveau de la valve pulmonaire. Le ventricule droit à un obstacle à l’éjection vers l’artère pulmonaire.
On fait le diagnostic sur un souffle (souvent important car l’artère pulmonaire est très superficielle, plus que l’aorte et les autres structures cardiaques). Les patients sont le plus souvent asymptomatiques. Si la sténose est importante, elle peut être levée grâce à une dilatation par ballonnet lors d’un cathétérisme cardiaque. Dans de rare cas, la chirurgie est nécessaire pour faire une plastie voire un remplacement de la valve pulmonaire.
5- Cardiomyopathies
Les cardiomyopathies pédiatriques sont très rares (incidence de 1 sur 100 000). Les phénotypes décrits sont les même que chez les adultes :
- Les cardiomyopathies dilatées (CMD) qui représentent 51% des cardiomyopathies de l’enfant
- Les cardiomyopathies hypertrophiques (CMH) qui représentent 42% des cardiomyopathies de l’enfant
- Les cardiomyopathies restrictives (CMR) qui représentent 2.5% des cardiomyopathies de l’enfant.
Parfois on peut avoir une hypertrabéculation du myocarde associé à un de ces phénotypes.
La présentation clinique varie selon l’âge :
- Chez les nouveaux nés ou nourrissons, il s’agit le plus souvent de décompensations cardiaques (polypnée, tachycardie, pâleur, mauvaise prise pondérale)
- Chez les enfants âgés de 1 à 6 ans, il s’agit la plupart du temps de symptômes frustres de douleurs abdominales et une mauvaise prise pondérale. Il s’agit souvent d’enfants qualifiés de calme et le symptôme de dyspnée d’effort sont souvent absents, masqués par l’autolimitation de l’enfant.
- Chez les enfants de plus de 12 ans, le tableau clinique est plus semblable à celui des adultes avec notamment l’essoufflement à l’effort parfois diagnostiqué comme de l’asthme d’effort, des douleurs thoraciques, des palpitations ou des malaises ou syncope.
Le traitement est essentiellement médicamenteux. On utilise les mêmes traitements que chez l’adulte (b-bloquants, IEC, antiarythmique, spironolactone etc…) avec des adaptations posologiques par rapports au poids de l’enfant. La pose d’un défibrillateur se discute dans les cardiomyopathies hypertrophiques et un score de risque pédiatrique a été développé pour cette population. Dans de rare cas, la transplantation cardiaque peut être proposée.
Pour conclure, ces différentes pathologies peuvent se manifester par des signes d’insuffisance cardiaque. Il est important de savoir les repérer afin d’avoir une prise en charge adaptée. Le rôle propre infirmier (surveillance clinique) a toute sa place afin de pouvoir anticiper l’aggravation de ces maladies et/ou le dépistage en lien avec les médecins.
Vous devez être connecté pour poster un commentaire