Principes de l’ablation et les différentes énergies
Céline Leroi, Groupe Hospitalier du Havre, Le Havre
Janvier 2025
1. Principe de l’ablation
a. Historique de l’ablation
L’ablation a été découverte fortuitement au décours d’une exploration endocavitaire chez un patient porteur d’une cardiopathie ischémique. L’intervention s’était compliquée d’une tachycardie ventriculaire traitée par la délivrance d’un choc électrique externe alors que les sondes d’exploration étaient toujours à proximité du nœud auriculoventriculaire. L’arc électrique formé entre les sondes et les palettes de défibrillation a provoqué un échauffement secondaire à la résistance des tissus au passage du courant. La température atteinte a été suffisante pour provoquer une nécrose myocardique sur le trajet du champ électrique (1). Du fait de sa proximité, le nœud auriculo-ventriculaire a été détruit avec apparition d’un bloc auriculo-ventriculaire complet dans les suites de la défibrillation. Les premières recherches visant à maitriser ce phénomène ne se développeront que bien plus tard sous forme de fulguration. Elle consistait à reproduire volontairement l’expérience mentionnée en développant un champ électrique entre une plaque située à la surface du corps du patient et une sonde endocavitaire située à proximité du site d’intérêt que l’on souhaite détruire. L’objectif était de provoquer une élévation telle de la température en regard des tissus traversés par le champ électrique qu’elle provoquait la nécrose de ceux-ci. Cette technique nécessitait bien évidement une anesthésie générale (1).
b. Concept général de l’ablation
L’objectif de l’ablation est de détruire des foyers anormaux électriques cardiaques afin d’empêcher leur propagation au reste des tissus ou de bloquer des circuits anormaux de conduction électrique. Le but est de rendre le myocarde non arythmogène par une cicatrice électriquement neutre. La création d'une lésion par différentes sources d’énergie possibles entraîne la mort cellulaire et la perte de la propriété de conduction électrique des cellules.
L’abord est transcutané (généralement au niveau de la veine fémorale droite), permettant la montée de sondes endocavitaires. La localisation anatomique du substrat arythmogène à traiter, son ancienneté, le rapport bénéfice/risque pour le patient mais également une bonne compréhension de la biophysique de l’ablation par cathéter, permettra à l’opérateur de choisir la technologie d’ablation optimale qui est une condition préalable à une procédure effectuée en toute sécurité.
c. Les différentes cibles d’ablation
Il peut s’agir soit de foyers focaux, soit de micro ou macro réentrées :
- Ablation focale :
Les tachycardies focales atriales ou ventriculaires peuvent être repérées en cartographie par un code couleur qui indique le point d’émergence le plus précoce. L’activation se fait en tache d’huile, de façon concentrique autour d’un foyer qui représente l’origine de la tachycardie ou de l’extrasystole et indique l’endroit où faire l’ablation.
- Ablation d’un circuit réentrant :
Il s’agit d’un circuit qui tourne, représenté par toutes les couleurs en cartographie. Il y a des macro-réentrées (zone large) ou des micro-réentrées (zone localisée). Il faut réaliser une ligne de bloc avec des points d’ablation contigus entre deux structures qui ne conduisent pas le courant (structures anatomiques ou cicatrices pré existantes) pour bloquer le circuit. Il faut repérer l’isthme critique qui est une zone de conduction lente entre deux cicatrices et réaliser la ligne la plus courte possible.
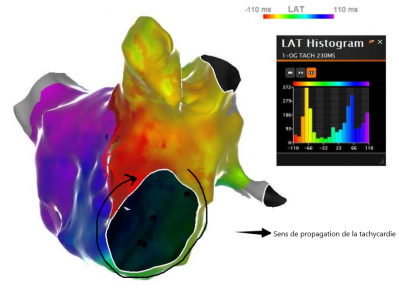
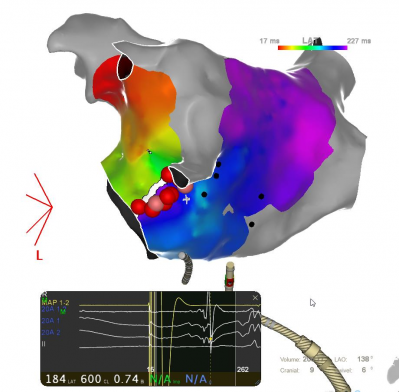
Ligne d’ablation d’une macro-réentrée dans l’oreillette gauche, procédure au GHH, Dr Auquier , système Carto Biosense
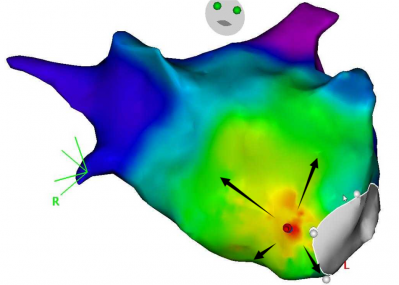
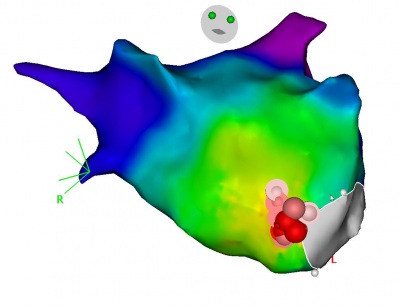
Ablation d’une tachycardie atriale focale dans l’oreillette gauche, procédure au GHH, Dr Auquier, système Carto Biosense
Pour les flutters les plus courants, la tachycardie passe par : l’isthme cavo tricuspidien (entre la veine cave inférieure et la valve tricuspide) pour le flutter droit, l’isthme mitral (entre la veine pulmonaire gauche inférieure et l’anneau mitral) pour un flutter gauche péri mitral, entre les deux veines pulmonaires supérieures pour un flutter du toit de l’oreillette gauche.
Structures qui ne conduisent pas le courant :
- Veines isolées (veines pulmonaires, veines caves)
- Valves (tricuspide, mitrale)
- Cicatrice (amas de cellules mortes)
d) Les différents systèmes de cartographie et cathéters
Plusieurs laboratoires ont développé chacun leur propre système de cartographie et mettent à disposition des praticiens différents cathéters d’ablation et de cartographie.
- Cathéters de cartographie :
Leurs nombres d’électrode varient pour permettre une reconstruction plus rapide et plus précise des différentes cartes de cartographie. Par Exemple : Abbott propose le cathéter ADVISOR HD GRID avec 16 électrodes, Boston le cathéter INTELLAMAP ORION avec 64 électrodes, Biosense le cathéter PENTARAY NAV avec 20 électrodes…
Leur maniabilité est différente en fonction d’une poignée uni ou bidirectionnelle, de courbures différentes et les cathéters sont plus ou moins rigides.
- Cathéters d’ablation :
Ils ont également des caractéristiques différentes en fonction des constructeurs :
On peut citer la présence de capteur magnétique ou non pour une visualisation du cathéter, la présence de capteur de force de contact au niveau de l’extrémité distale du cathéter qui confirme le contact mécanique, la stabilité du cathéter au tissu et alerte en cas de contact excessif pour une sécurité accrue ou encore présence de systèmes d’irrigation variés par le positionnement et le nombre d’orifice à l’extrémité du cathéter. Il existe également des cathéters non irrigués pour les ablations moins complexes comme les ablations de flutter droit, de nœud auriculo-ventriculaire.
Les cathéters peuvent disposer d'une zone d’ablation de 4 ou 8mm qui sera choisi en fonction de la localisation de l’arythmie, de la taille du tissu à ablater.
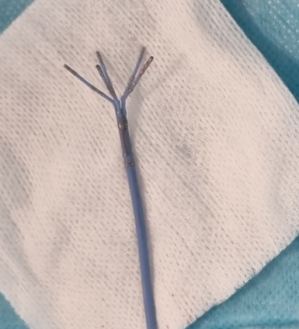
Cathéter pentaray , Biosense
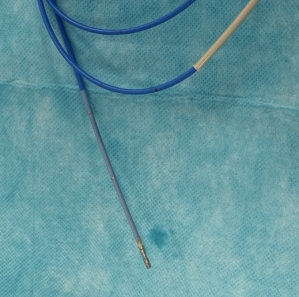
Cathéter d’ablation smartouch , Biosense
e) Le système de reconstruction tridimensionnelle
Pour de nombreuses ablations, on utilise un système complexe de cartographie 3D enregistrant l’anatomie des cavités cardiaques ainsi que les signaux électriques endocavitaires. Ces systèmes de cartographie électroanatomique ont grandement amélioré la capacité à traiter les arythmies auriculaires et ventriculaires complexes et sont maintenant omniprésents dans tous les laboratoires d’électrophysiologie cardiaque.
Il existe différents systèmes de navigation présentant des variations de coût, de courbe d’apprentissage, d’application de procédures. Les avantages du système de navigation sont une réduction des émissions des rayons X, une stabilité améliorée du cathéter, une sécurité accrue pour les patients.
Les systèmes de cartographie des différents constructeurs améliorent sans cesse leurs performances , leurs algorithmes pour obtenir une résolution du modèle anatomique 3D la plus précise possible, détecter et compenser les mouvements du patient pour une stabilité de la carte pendant toute la procédure, collecter des données durant tout le cycle respiratoire, visualiser la propagation de l’influx électrique, créer des cartes électro-anatomiques en moins de temps et avec une densité de points plus importante…
Il existe plusieurs types de carte :
- Les cartes anatomiques de la cavité cardiaque concernée, superposable avec d’autres types d’imagerie comme un scanner des veines pulmonaires.
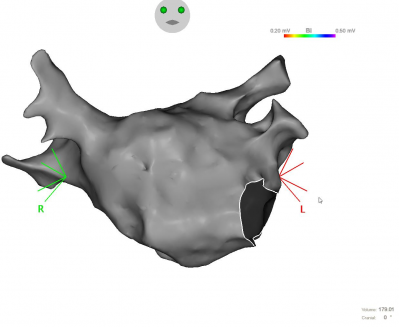
Procédure au GHH, Dr Auquier, système carto Biosense, carte anatomique de l'oreillette gauche
- Les cartes de voltage permettant de mesurer l’amplitude des signaux électriques, de visualiser du tissu sain ou pathologique, cicatriciel par un codage couleur associé : Le violet désigne le tissu sain (le signal est bien volté), le rouge désigne le tissu pathologique et ou silencieux électriquement.
 Procédure au GHH, Dr Auquier, système carto Biosense, carte de voltage de l'oreillette gauche
Procédure au GHH, Dr Auquier, système carto Biosense, carte de voltage de l'oreillette gauche
- Les cartes d’activation permettant une analyse de la propagation de l’activité électrique également associé à un codage couleur.
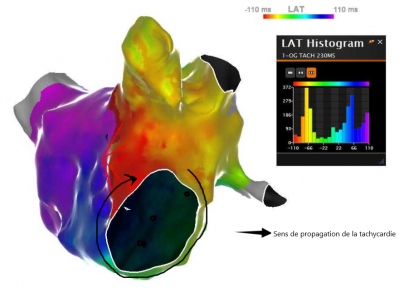
Procédure au GHH, Dr Auquier, système Carto Biosense, carte d'activation d'un flutter périmitral
2. Les différentes énergies
a) La radiofréquence (RF)
Il s’agit de l'énergie la plus répandue et utilisable pour tous les types de troubles du rythme. Cette technologie est simple, elle a un taux de réussite élevé et un faible taux de complication.
Fonctionnement de la radiofréquence
Le cathéter émet un courant de RF à une puissance définie en Watts pour effectuer des lésions. Les électrons pénétrant dans les cellules provoquent la vibration des molécules situées dans celles-ci, entraînant l’échauffement de ces dernières. Le tissu myocardique ainsi traversé par ce courant se comporte comme une résistance chauffante qui entraine une élévation de température donc des dommages cellulaires et donc des lésions irréversibles. C’est le tissu qui chauffe le cathéter et non l’inverse. La température du myocarde est supérieure à celle de l’extrémité du cathéter enregistrée sur le générateur. (2)
Il existe 2 types d’échauffement :
L’échauffement résistif causé par la résistance du tissu au courant de radiofréquence ; Il s’étend sur une profondeur de 1 à 3 mm ; C’est l’endroit où la température est la plus importante.
L’échauffement conductif causé par la propagation de la chaleur dans le tissu ; Il s’étend sur une profondeur de 3 à 7 mm ; C’est lui qui est transmis à l’électrode distale et permet d’afficher une température sur le générateur. (2)
Sans un bon contact du cathéter, seul le sang endocavitaire sera chauffé et l’énergie myocardique ne sera pas suffisante pour provoquer la nécrose du tissu ciblé.
Le courant RF est généralement délivré en mode unipolaire depuis l’électrode de l’extrémité du cathéter d’ablation à un patch de mise à la terre (électrode indifférenciée) sur la peau du patient.
Les températures importantes :(2)
50 °C = mort cellulaire
75°C = carbonisation
100°C = ébullition, steam pop
Le steam pop ou pop de vapeur correspond à un échauffement excessif des tissus myocardiques entrainant une ébullition et une vaporisation de gaz avec éruption localisée. L’éruption transmurale peut se compliquer d’une perforation cardiaque avec tamponnade dans certains cas. (3)
L’isotherme 50°C détermine la limite de la lésion. Une plus grande taille de lésion est obtenue avec une puissance plus élevée et des températures tissulaires intramurales plus élevées.
Les fréquences les plus basses sont susceptibles de stimuler le muscle cardiaque et les nerfs, entrainant des arythmies et une sensation de douleur ; Les fréquences les plus élevées entraînent un échauffement des tissus.
La lésion créée et sa taille dépendent de la quantité d’énergie reçue par le tissu en fonction de la puissance délivrée, de la force de contact du cathéter et du temps d’application mais aussi de la stabilité du cathéter, de la taille de l’électrode en fonction du type de cathéter et du flux sanguin qui dissipe la chaleur par convection. (4)
Avantages et inconvénients :
La RF permet de faire une ablation point par point ; c’est une énergie de référence, fiable et efficace.
Un titrage minutieux de l’énergie délivrée peut éviter les complications locales, les dommages collatéraux aux structures environnantes, y compris l’œsophage et le nerf phrénique.
Les cathéters d’ablation peuvent être irrigués pour permettre des lésions plus profondes, améliorer la sécurité en diminuant le risque de caillots et de steam pop en évitant les montées excessives de température.
Concernant l’ablation de FA persistante par RF, la principale limite vient du risque de réaliser une ablation trop extensive incluant le substrat et donc d’augmenter le risque de tachycardies atriales cicatricielles, d’allonger le temps de procédure et donc le taux de complication (risque embolique, perforation…).
b) La cryothérapie
C’est une source d’énergie moins répandue que la radiofréquence mais utilisée en routine dans de nombreux centres.
Fonctionnement de la cryothérapie :
Cette thérapie utilise du monoxyde d’azote liquide envoyé sous pression dans un cathéter ou un ballon, où sa transformation en phase gazeuse va refroidir les tissus avoisinants jusqu’à -80°C. Chaque application dure 180-240 secondes et le cathéter colle au tissu avec une parfaite stabilité. Le gaz est ensuite évacué par un mini tube au sein du même cathéter ou ballon.
La destruction tissulaire est liée à la création de cristaux de glace intracellulaires détruisant les membranes cellulaires et altérant le métabolisme et l’activité électrique. Le réchauffement du tissu à l’arrêt de l’application du froid va amplifier ce phénomène.
Une particularité de la cryothérapie est de pouvoir faire un palier à -30°C pendant lequel les lésions créées sont encore réversibles. Cette propriété est intéressante pour le traitement d’arythmies proches du nœud auriculo-ventriculaire pour lesquelles le risque de bloc auriculo-ventriculaire est significatif lors d’ablation par radiofréquence.
L’effet de la température sur les tissus :
Entre 0°C et 32°C : altération réversible de la membrane cellulaire et du potentiel d’action
Entre 0°C et -60°C : congélation : déshydratation extra-cellulaire et destruction intra-cellulaire
Puis réchauffement : augmentation de la taille des cristaux de glace qui entrainent la dislocation membranaire et la destruction cellulaire
Post réchauffement : nécrose cellulaire et phénomènes inflammatoires (5)
Avantages et inconvénients :
L’efficacité de la cryothérapie est comparable à la radiofréquence pour l’isolation des veines pulmonaires dans la fibrillation atriale paroxystique.
En effet, l’Etude FIRE and ICE montrent la non infériorité de cette technique par rapport à la radiofréquence sur la survenue du critère primaire d’efficacité (absence de récidive de FA, flutter atrial, tachycardie atriale, reprise d’un traitement antiarythmique, nouvelle ablation). Plus récemment l’étude CIRCA-COSE n’a pas retrouvé de différence sur le maintien en rythme sinusal à 1 an entre les deux techniques. Dans l’ablation de FA paroxystique, l’ablation par l’une ou l’autre de ces deux énergies ne fait donc plus débat et dépend principalement des habitudes de chaque centre et de la disponibilité de la technique.
Le principal intérêt de la cryothérapie est de provoquer, en une application, une lésion circonférentielle permettant une déconnexion plus rapide de l’ensemble de l’ostium de la veine pulmonaire. La stabilité du cathéter en cryothérapie est supérieure à la radiofréquence, car lors de la phase de refroidissement, celui-ci va adhérer à la paroi myocardique.
La complication spécifique dans cette indication est la paralysie du nerf phrénique lors de l’isolation des veines droites.
La principale limite de la cryoablation vient de la forme du cathéter qui n’est pas adaptable à des cibles focales ou à la réalisation de lignes d’ablation. Cela limite son utilisation lors de procédure concernant la FA persistante où des ablations de cibles focales ou des réalisations de ligne d’ablation vont être nécessaire.
Cette énergie est très sûre dans les ablations proches des voies de conduction normales. Il n’y a pas de risque de bloc atrio ventriculaire mais le risque de récidive est plus élevé. Elle est généralement réservée à certaines indications : réentrées intra-nodales, faisceaux accessoires parahissiens ou septaux chez l’enfant ou l’adulte jeune.
Les avantages de cette technologie reconnus sont une diminution des complications thromboemboliques potentielles, une amélioration de la stabilité du cathéter lors des applications, une propension moindre à endommager les structures vasculaires.
c) L’électroporation
L’électroporation est une technologie récente pour le traitement des arythmies par ablation qui utilise un champ électrique pulsé et non plus une énergie thermique.
Elle a été utilisée pour la première fois dans l’ablation du nœud auriculo-ventriculaire dans les années 1980 par fulguration (par Gallagher). Mais ce n’est que 30 ans plus tard que les premières études animales sur l’électroporation du myocarde seront réalisées. Le premier essai de faisabilité et de sécurité chez l’homme a été publié en 2018. (6)
Fonctionnement de l’électroporation :
Il s’agit d’envoyer via un cathéter des micro-chocs électriques de haut voltage pour ouvrir des pores à l’échelle nanométrique dans les membranes des cellules cardiaques ciblées, impliquées dans les arythmies, ce qui entrainent leur destruction.
La délivrance de ce champ à haute tension reste un challenge technique. Son intensité et son effet dépendent de très nombreux paramètres tels que la durée d’application, le niveau de tension (de 1 à 10 kVolt), la forme et la pente de l’onde, son caractère mono ou biphasique, le nombre d’impulsions … Chacune de ces variables va pouvoir être modifiée pour obtenir l’effet tissulaire souhaité. Chaque constructeur a son programme préenregistré avec ses différents paramètres. (6)
Avantages et inconvénients :
L’utilisation de cette nouvelle énergie permet de raccourcir le temps d’intervention.
Cette technologie à l’avantage de ne pas engendrer de dommage pour les tissus collatéraux non cardiaques comme les cellules vasculaires, nerveuses…car le niveau d’énergie pour léser une cellule est différent entre un muscle, un nerf, un vaisseau, cette technologie est cardiosélective. Des travaux ont montré une grande sensibilité du tissu myocardique à l’égard de l’électroporation.
L’électroporation est donc perçue comme une alternative plus sûre, puisqu’elle épargne les tissus et organes environnants (œsophage, nerf phrénique) contrairement aux méthodes thermiques.
Un autre avantage est à souligner : Au contraire de la RF, l’électroporation est une énergie qui produit peu de chaleur locale et donc diminue le risque de sténose des veines pulmonaires et l’extension de fibrose de l’oreillette (syndrome de l’oreillette rigide)
Peu de complications nouvelles sont apparues avec cette technologie comme le risque de spasme coronaire ou le faible risque d’hémolyse en cas de nombre trop important d’application.
Cette technologie est très prometteuse et va avoir certainement une place prépondérente dans les années à venir, notamment dans l’ablation de FA.
d) Les autres technologies moins utilisées
- Les Ultra-sons :
Cette forme d’énergie provoque une lésion tissulaire à médiation thermique en utilisant une forme d’énergie à vibration très rapide en Hertz (nombre d’oscillation par seconde). Le transducteur d’ablation à ultra-sons contient un élément piézoélectrique qui vibre à une fréquence fixe lorsque l’électricité est appliquée.
Les ultra-sons se propagent en un mouvement d’ondes sonores qui provoque des compressions et décompressions des tissus. Ce mouvement mécanique des particules est absorbé et converti en chaleur dans le tissu. Cet effet thermique provoque des lésions tissulaires si l’élévation de la température est suffisante et maintenue pendant une période adéquate (6)
Après un enthousiasme préclinique et clinique initial, la majorité des systèmes d’ablation par ultra-sons ont cessé de se développer.
- Le Laser :
C’est une technologie récente utilisant un système à énergie laser, guidée par une caméra vidéo miniature. Elle représente une évolution attendue grâce à la précision de ses lésions guidées par la vue et au respect des tissus adjacents. L’endoscope permet de déterminer avec précision l’endroit où effectuer la lésion. L’énergie laser focalisée, dont la puissance est ajustable selon l’épaisseur des veines pulmonaires, permet une ablation précise et complète.
La lésion tissulaire créée par l’énergie laser est de nature thermique et son effet est fonction de la densité de puissance du laser sur le tissu. Lors de l’irradiation des tissus, la lumière est dispersée et absorbée dans une mesure qui dépend du diamètre du faisceau et de la propriété optique du tissu. L’énergie est absorbée de façon sélective jusqu’à une profondeur de plusieurs millimètres. L’échauffement du tissu provoque alors une nécrose focale du tissu myocardique. (7)
Conclusion
Depuis quelques années, la place du traitement des arythmies par ablation a nettement progressé. Dans certains cas, comme la FA paroxystique symptomatique, ce traitement est même en première ligne dans les dernières recommandations (ESC 2024).
Un élan d’enthousiasme est arrivé concernant l’électroporation dans le traitement de la FA paroxystique depuis que cette énergie s’est révélée au moins aussi efficace et sûre que les méthodes thermiques habituelles (radiofréquence ou cryothérapie). (6) Elle est perçue comme une alternative plus sûre, puisqu'elle épargne les tissus et organes environnants. Elle devrait permettre également de s’orienter plus facilement vers un traitement de la FA en ambulatoire du fait de sa rapidité de réalisation.
Les énergies thermiques gardent toutefois une place primordiale à ce jour dans le traitement des autres arythmies quelles soient auriculaires ou ventriculaires. (6)
Quel que soit le type d’énergie retenu par le cardiologue pour une procédure, le paramédical a un rôle très important : il doit connaitre les différentes technologies, les différents matériels, être à l’aise dans leurs manipulations, connaitre et anticiper les différentes complications possibles.
Références
1. Nathanael Auquier, 2013, apport des nouvelles technologies dans l’ablation de fibrillation atriale paroxystique par cryothérapie, thèse de doctorat en médecine, faculté de médecine de Rouen
2. Shoei K. Stephen Huang, MD-- John M.Miller, MD ;2015 ;Catheter ablation of cardiac arrhythmia ; p5 à 12
3. HeartRhythm Case Rep. 2021 May 3;7(7):502–505. doi: 10.1016/j.hrcr.2021.04.013
4. F.Tréger, A.Behaghel ;2021 Cardiologie pratique ; Ablation de la FA, le chaud ou le froid
5. Shoei K. Stephen Huang, MD-- John M.Miller, MD ;2015 ;Catheter ablation of cardiac arrhythmia ; p50
6. S .Combes, S.Boveda ;2022 Cardiologie pratique ; L’électroporation :le futur de l’ablation des troubles du rythme cardiaque
7. Shoei K. Stephen Huang, MD-- John M.Miller, MD ;2015 ;Catheter ablation of cardiac arrhythmia ; p71 à 73
8. Shoei K. Stephen Huang, MD-- John M.Miller, MD ;2015 ;Catheter ablation of cardiac arrhythmia ; p74 à 79
Vous devez être connecté pour poster un commentaire
